Tópico 54- Deslocalização π:
butadieno
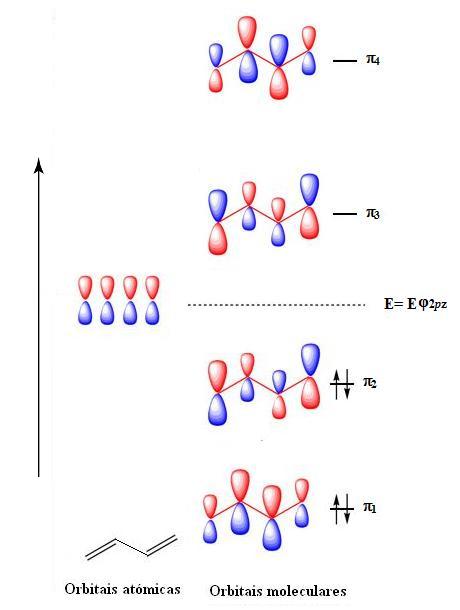
As 4 orbitais pz que não entraram na hibridação só podem coalescer lateralmente estabelecendo ligações π. As orbitais pz apresentam uma pequena sobreposição pelo que neste caso não é válida a aproximação de ligações localizadas e é necessário recorrer à TOM (link) para descrever os electrões do butadieno e de moléculas semelhantes que apresentam ligações duplas alternadas. Estas moléculas são designadas polienos conjugados porque existe conjugação ou deslocalização π decorrente do facto de existir interferência entre as orbitais pz (paralelas) de átomos de carbono adjacentes. A deslocalização π é utilizada no EV para explicar porque razão nestas moléculas a distância C1-C2 (ou C3-C4) é maior que a distância C-C no etileno e a distância C2-C3 é menor que a distância C-C no etano.
Assim, à luz do EV, as duas ligações π do butadieno dizem-se deslocalizadas sobre os quatro átomos de carbono. Uma descrição mais rigorosa é obtida através da TOM em que consideramos a combinação linear das quatro orbitais atómicas pz obtendo quatro orbitais moleculares, π1 a π4, das quais as duas de menor energia estão preenchidas.