A descrição da ligação química em moléculas poliatómicas através da TOM/CLOA (link) não é trivial, embora existam inúmeros programas que permitem efectuar o cálculo da distribuição espacial e da energia das orbitais de moléculas poliatómicas, bastando para isso fornecer a estrutura tridimensional da molécula. É também possível uma abordagem mais qualitativa, utilizando a Teoria dos Grupos de Simetria.
A descrição mais corrente e intuitiva, apesar de menos rigorosa, da ligação em moléculas poliatómicas considera ligações localizadas entre átomos adjacentes, resultantes da partilha de pares de electrões, contribuindo, em geral, cada átomo com um electrão para cada par partilhado. A ideia de que os átomos formam ligações covalentes por partilha de pares de electrões foi sugerida por G. N. Lewis em 1916 (popup: Em 1902, logo após a descoberta do electrão, Gilbert Newton Lewis propôs um modelo em que a ligação química seria assegurada por forças electrostáticas resultantes da transferência de electrões entre os átomos constituintes de uma determinada molécula. Este modelo tratava os electrões como se eles fossem cargas eléctricas em repouso e foi refinado depois de Bohr ter publicado o seu modelo do átomo. No novo modelo, Lewis propunha que as ligações químicas eram estabelecidas por interacção dos electrões de valência dos átomos participantes. Recordando que o electrão fora descoberto menos de 10 anos antes e que apenas em 1913 Bohr esboçara o seu modelo atómico percebemos o arrojo desta proposta.), mas só em 1927, Walter Heitler e Fritz London mostraram como esta partilha estabiliza uma molécula covalente em relação aos átomos constituintes. O modelo de Heitler-London é a base da Teoria do Enlace de Valência (link). Linus Pauling (link) teve um papel importante para o desenvolvimento da teoria com a introdução do conceito de orbitais híbridas.
No Enlace de Valência a descrição das moléculas assenta essencialmente na covalência ou «capacidade de ligação» de um dado átomo. Neste modelo, a ligação entre dois átomos é descrita através da coalescência (enlace) de duas orbitais atómicas de valência semipreenchidas (uma de cada átomo), ou ainda através da sobreposição de uma orbital atómica de valência totalmente preenchida com uma vazia tomando, neste caso, a designação de ligação covalente dativa.
Um átomo formará tantas ligações quantas as possibilitadas pela sua configuração electrónica de forma a diminuir a sua energia tanto quanto possível. Por exemplo, o carbono, com 4 electrões de valência, fará quatro ligações, o azoto, 5 electrões de valência, estabelece 3 ligações e dispõe de um par de electrões não partilhado que poderá utilizar para estabelecer uma ligação covalente dativa, o oxigénio, que apresenta 6 electrões de valência, estabelecerá 2 ligações ficando com dois pares de electrões não partilhados, que poderá utilizar em duas ligações covalentes dativas.
No EV, a molécula de CH4 é explicada pela
formação de quatro ligações σ equivalentes
do C com cada um dos hidrogénios [link metano], resultantes da
sobreposição de quatro orbitais híbridas sp3
[link para
hibridação sp3] do carbono com as orbitais 1s
de cada um dos átomos de hidrogénio (Fig. 1)
Figura 1 – Descrição do metano à luz do EV.
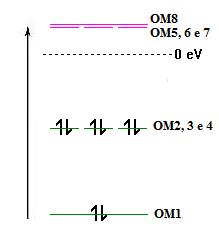
Na descrição do metano pela TOM, obtém-se
8 orbitais moleculares de valência (4 do carbono e uma de cada
hidrogénio) que se combinam linearmente para formar 8 orbitais
moleculares das quais as quatro de mais baixa energia, OM1 a OM4,
estão ocupadas - Fig. 2).

Figura 3 - Orbitais moleculares ocupadas do metano. Clique nos
botões indicados para visualizar as quatro orbitais.
As aproximações utilizadas no EV não só simplificam como tornam mais intuitiva a representação das moléculas. No entanto, o EV é apenas um modelo da ligação química que falha para átomos pouco electronegativos (como é o caso do silício) ou orbitais com pequena sobreposição (como é o caso de orbitais p em ligações π conjugadas) e nestas condições é necessário retomar o formalismo da TOM para descrever os electrões em causa.