Hibridações
Agora que sabem prever as geometrias de compostos moleculares vamos ver quais são as orbitais atómicas de valência que dão origem a estas geometrias.
Uma vez que as orbitais de valência que são soluções da equação de Schrödinger não justificam as geometrias moleculares é necessário introduzir o conceito de hibridação. Logo nas primeiras aulas de Química Geral vimos que a resolução da equação de Schrödinger só é possível para o átomo de hidrogénio e fornece soluções para as funções de onda (e energias) das orbitais atómicas possíveis para o electrão deste átomo:
1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, etc. Para átomos polielectrónicos, para os quais não sabemos qual o potencial a que estão sujeitos os electrões, os níveis de energia possíveis (e correspondentes funções de onda) estão deslocados em relação àqueles que sabemos calcular exactamente para o electrão do átomo de hidrogénio. Uma orbital atómica corresponde a um estado de energia de um electrão sob a atracção de um núcleo. Este estado de energia (e a função de onda) é diferente para diferentes átomos e altera-se quando um átomo está ligado a outro e os electrões estão sujeitos ao potencial conjunto dos dois núcleos. A hibridação de funções de onda atómicas tem um fundamento matemático e quântico sólido mas fora do âmbito da cadeira.
Uma vez que vamos tratar moléculas constituídas por elementos representativos que apresentam apenas uma ou quatro orbitais de valência, só vamos considerar geometrias de moléculas em que os átomos constituintes apresentam no máximo quatro zonas com electrões à sua volta.

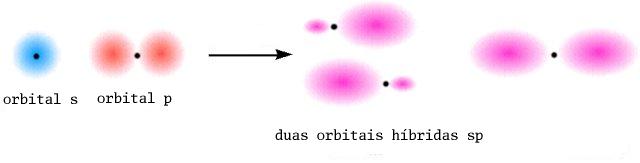
Por exemplo, a molécula H-Be-H, em que o Be (configuração electrónica de valência 2s2 ) apresenta duas zonas com electrões, é descrita por duas ligações sigma obtidas por sobreposição das orbitais 1s dos 2 átomos de H com as duas orbitais híbridas sp do Be que fazem entre si ângulos de 180º. A molécula H-Be-H é linear.
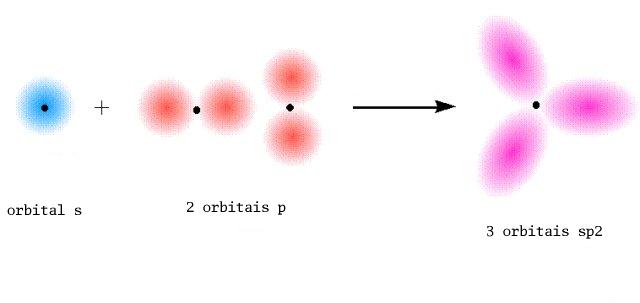
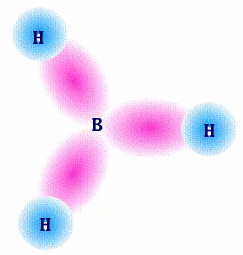
A molécula BH3 em que o B (configuração electrónica de valência 2s22p1 )apresenta três zonas com electrões e consequentemente geometria triangular plana, é descrita por três ligações sigma obtidas por sobreposição das orbitais 1s dos 3 átomos de H com as três orbitais híbridas sp2 do B.
No etileno, H2C=CH2, os dois átomos de carbono, cada um dos quais rodeado por três zonas com electrões, apresentam hibridação sp2 .As orbitais híbridas de cada carbono estabelecem ligações sigma com as orbitais 1s dos hidrogénios e com a orbital sp2 do outro carbono. As orbitais p estabelecem uma ligação pi.
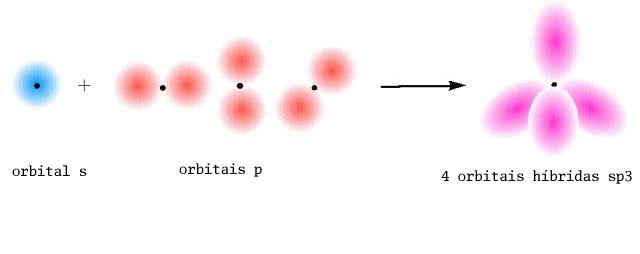
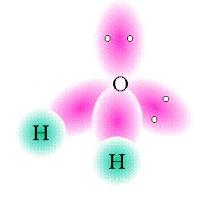
No metano, CH4, a orbital 1s de cada átomo H estabelece uma ligação sigma com uma orbital híbrida sp3 para formar uma ligação C-H. As 4 ligações C-H fazem entre si ângulos de ~109º. O azoto na amónia e o oxigénio na água apresentam igualmente hibridação sp3.
|
|
|
Resumindo:
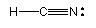
Exemplo:
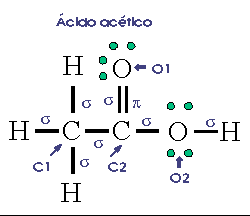
Ácido acético, CH3COOH
2002 Palmira Silva