| Química
Exame 2008-09 Mestrados Integrados em Eng. Mecânica e Aeroespacial e Licenciatura em Eng. e Arquit. Naval Duração: 3 horas I [cotação: 1.5 + 1.5] 1 – Para qual dos elementos, potássio (K, Z=19) ou cloro (Cl, Z=17) é maior a energia libertada pela captura de um electrão pelo átomo no estado gasoso? Justifique com base em argumentos quantitativos. X(g) + e? ® X- (g) 2 – Ondas electromagnéticas de comprimento de onda de 70 pm (região dos raios X) são apropriadas para experiências de difracção em cristais. Experiências idênticas poderiam ser realizadas com electrões. Qual teria de ser a velocidade desses electrões para que o comprimento de onda associado fosse o mesmo, isto é, 70 pm? II [cotação: 2.5 + 1.5] 1 – Considere a molécula de estireno, C6H5C(H)=CH2. Indique as hibridações e pares electrónicos isolados dos átomos, tipos e ângulos das ligações e orbitais moleculares deslocalizadas, explicitando o número de orbitais moleculares e seu preenchimento. 2 – A partir do estireno pode formar-se um polímero, o poliestireno. Indique, justificando, como classifica a reacção de polimerização e escreva um fragmento da cadeia de polímero com três unidades repetitivas.
III [cotação: 4 (2 + 1+1)]
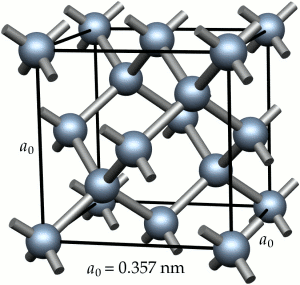
1 – A figura representa a estrutura do diamante. A aresta da célula unitária cúbica é de 0,357 nm. a) Calcule a massa volúmica (também designada por massa específica ou densidade absoluta) do diamante em kg/m3
b) Pela teoria do enlace de valência (TEV), explique a ligação química no diamante: tipos de orbitais envolvidas, hibridações, ângulos entre ligações.
c) A temperatura de fusão do diamante (C) é superior a 3350ºC enquanto a do benzeno (C6H6) é de 5ºC. Explique esta tão grande diferença de valores.
IV [cotação: 2.5 (1 + 1 .5) + 2.5 (1+1+0.5)] 1 – Para a reacção: 2HI (g) ? H2 (g) + I2 (g) a 699 K, a constante de equilíbrio termodinâmica Kp= 0,0182. Num recipiente de 10 dm3, e 699K, havia num determinado instante 0,3 mol de HI, 0,1 mol de H2 e 0,2 mol de I2. a) Em que sentido evoluiria a reacção. Justifique. b) Qual a composição da mistura reaccional quando se atingisse o equilíbrio. 2 – Considere a seguinte pilha: Sn(s)¦Sn2+(aq) (0.02M)¦H+(aq) (0.5M)¦H2 (g) (1 bar)|Pt(s), a 25ºC.
a) Escreva as reacções parciais de eléctrodo, determine os potenciais dos dois eléctrodos e identifique o cátodo e o ânodo. b) Calcule a sua força electromotriz e escreva a reacção global. c) Após algum tempo de funcionamento, o pH no compartimento onde está mergulhado o eléctrodo de platina aumenta, diminui ou não sofre alteração? Justifique. V [cotação: 1 + 1 + 1 + 1] 1 – Calcule o valor do comprimento de onda da banda de absorção UV-Vis de menor energia da seguinte molécula: H2C=C(H)-C(H)=C(H)-C(H)=C(H)-CH2-CH2-C(H)=CH2 2 – Diga como poderia distinguir por testes de miscibilidade o conteúdo de dois frascos, sabendo que as substâncias neles contidas são etilenoglicol (CH2OHCH2OH) ou trans-1,2-dicloroeteno (CHClCHCl), dispondo de três solventes à sua disposição (H2O, CCl4 e CH3OH). 3 – Explique, com base nos equilíbrios químicos apropriados, a variação do pH da água do Luso após passagem por uma coluna contendo pedras de calcário. 4 - Na aula de laboratório verificou o aparecimento de cor vermelha em torno de um prego de ferro quando o ligou a uma placa de zinco por um fio metálico, estando ambas as peças mergulhadas num num gel com dois indicadores: um indicador de OH- (fenolftaleína – cor vermelha) e um indicador da presença de Fe2+ (ferricianeto de potássio – cor azul). Se em vez de uma placa de zinco, tivesse colocado uma placa de níquel, o que observaria? Justifique
Dados:
|