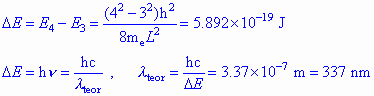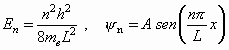|
1º
teste (Teste Exemplo Resolvido)
I
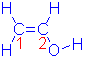
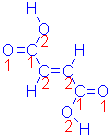
Considere a molécula de 1,3-butadieno [CH2CHCHCH2].
Explique como o modelo da partícula numa caixa unidimensional de
potencial prevê comprimentos de ligação C1-C2
mais curtos que o do ligação C2-C3
. Calcule o comprimento de onda da transição de menor energia
no UV-Vis previsto por este modelo e compare com o valor experimental
(238
nm).
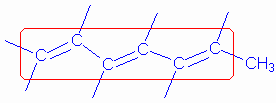
1,3-butadieno CH2=CH-CH=CH2
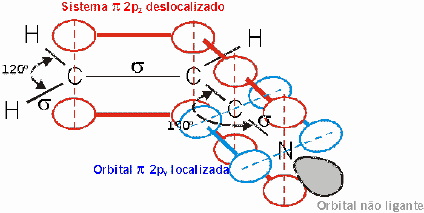
Esta molécula apresenta quatro
electrões p deslocalizados (provenientes
das
orbitais atómicas
2pz do C),
logo estão preenchidas as orbitais com n=1 e n=2. As funções de onda
que descrevem estes electrões são as indicadas na figura:
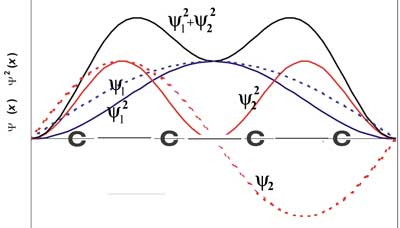
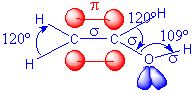
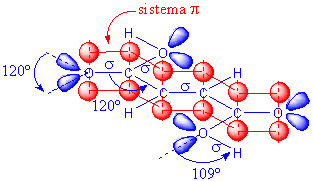
Na
figura também se representa o quadrado das funções de onda e a sua soma.
Como
vemos, a densidade electrónica entre C2 e C3 é menor do que entre C1 e
C2, que
é idêntica à densidade electrónica entre C3 e C4 (isto devido ao nodo
que a
função de onda n=2 apresenta no centro da caixa). Logo a distância
internuclear
C2 e C3 é
maior.
Tamanho da caixa, L = 4 x dC-C.
Transição de menor energia
entre os níveis n=2 e n=3.

O
comprimento de onda de absorção
do 1,3-butadieno previsto pelo modelo é menor (210 nm) do que o valor
experimental
(238 nm). Isto é devido
às aproximações inerentes ao modelo:
II
Explique os valores experimentais das energias de ionização
do azoto (N) e do oxigénio (O) que encontra na Tabela Periódica.
A energia de ionização é
proporcional a razão
(Zef /n)2 para o electrão em causa.
EI(N) = 14.5 eV
EI(O) = 13.6 eV
Configuração electrónica do azoto:
(1s2
)(2s2 2p3)
Zef (2p, N) = 7 -
(4x0.35 + 2x0.85) = 3.9
Configuração electrónica do
oxigénio: (1s2
)(2s2 2p4)
Zef (2p, O) = 8 -
(5x0.35 + 2x0.85) = 4.55
(Zef /n)2
(2p, N) = (3.9/2)2= 3.8
(Zef /n)2
(2p, O) = 5.2
A energia de ionização do oxigénio
deveria ser
superior à energia de ionização do azoto, uma vez
que a razão (Zef /n)2 é maior para o
electrão 2p do oxigénio. Experimentalmente verifica-se
que a energia de ionização do azoto é superior porque
as regras de Slater não contemplam o grau de preenchimento das
orbitais,
isto é, não consideram a repulsão interelectrónica.
No azoto o electrão é removido de uma orbital semipreenchida
enquanto no oxigénio o electrão é removido de uma
orbital completamente preenchida.
III
1.
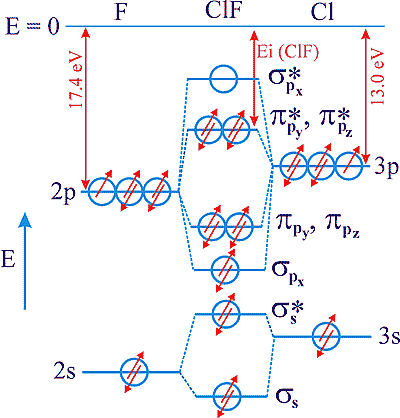
Desenhe o diagrama
de energias das orbitais moleculares do monóxido de azoto
(NO), identificando no mesmo diagrama as energias de ionização
dos átomos constituintes e os tipos de orbitais moleculares (s, p, etc.)
envolvidas. Determine a ordem
de ligação no NO
e preveja as propriedades magnéticas da molécula.
2.
Utilizando os dados da Tabela Periódica faça uma estimativa
do momento dipolar da molécula HF.
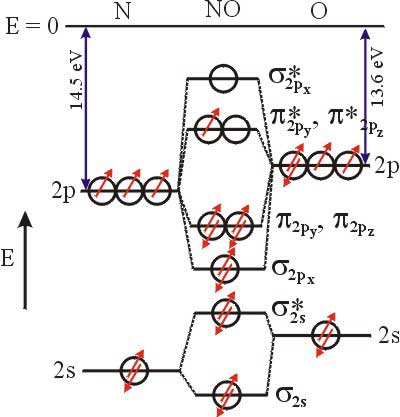
1.
Molécula NO
EI(N) = 14.5 eV
EI(O) = 13.6 eV
Configuração electrónica do azoto:
1s2
2s2 2p3
Configuração electrónica do oxigénio: 1s2
2s2 2p4
Diagrama de
energia das orbitais moleculares
Uma vez que a energia de ionização
do N é maior
que a energia de ionização do O as orbitais 2p do azoto têm
menor energia. Representando apenas as orbitais de valência de ambos
os átomos tem-se:
As
orbitais atómicas sigma 1s não coalescem significativamente. Ficam,
portanto,
como orbitais não ligantes.
NOTA:
Nesta molécula as orbitais sigma 2p e pi 2p ligantes, são quase
isoenergéticas (é a última molécula em que se observam os efeitos da
inversão sigma-pi). Porém, tal como indicado nas aulas, não se espera
que o
aluno tenha em conta a inversão sigma-pi.
OL = (nº de electrões ligantes
- nº de electrões
antiligantes)/2= (8 -3 )/2 = 2.5
A molécula é paramagnética.
2. Molécula HF
momento dipolar
(mHF) = q x d = %CI/100 x e
(carga do electrão)
x dHF
electronegatividade do H=2.2
electronegatividade do F=3.98
diferença de electronegatividades
= 1.78, a que corresponde uma percentagem de carácter iónico
%CI= 55% (lido
na Tabela Periódica)
dHF = rcov(H)
+ rcov (F) = (30 + 72)
x10-12 m = 102 x10-12 m
mHF
= 0.55 x 1.6x10-19 C x 102 x10-12
m
= 8.976 x10-30 C m = 2.7 D
Dados
e constantes de conversão:
h
(constante de Planck) = 6.62618 x 10-34 J s
c (velocidade da luz no vácuo) = 2.997925 x 108 m s-1
me (massa do electrão em repouso) = 9.10953 x 10-31
kg
e (carga do electrão) =1.60x10-19 C
dC-C (distância internuclear C-C) = 141 pm
1 electrão-volt (eV) = 1.60 x 10-19 C m
1 Debye (D) = 3.33 x 10-30 C m
Equações
para a partícula na caixa de potencial:
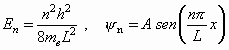
Cotação:
I. 1 val
II. 1.5 val III. 2.5 val
|