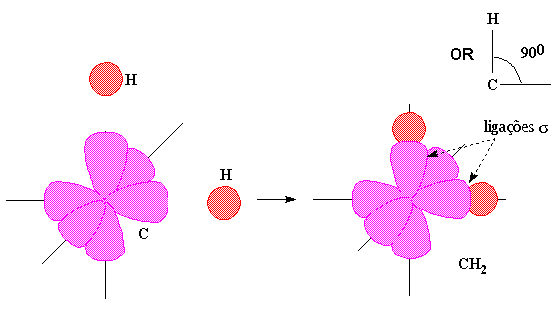
Na realidade, o ângulo de ligação
na água é cerca de 105° e não 90°. De igual
forma a configuração electrónica de valência
do carbono, 2s22p2, não
justifica nem o número de ligações equivalentes
estabelecido pelo carbono, por exemplo no metano (CH4), nem a
geometria destas ligações. De facto, apenas com duas orbitais
de valência semipreenchidas o carbono deveria formar duas ligações
fazendo entre si um ângulo de 90°, como no exemplo da hipotética
molécula de CH2. Nesta espécie, o carbono teria
dois pares de electrões não partilhados e estabeleceria duas
ligações sigma com as orbitais 1s dos dois átomos
de hidrogénio.