
Teoria do Enlace de Valência (TEV)
A ideia de que os átomos formam ligações covalentes por partilha de pares de electrões foi sugerida por G. N. Lewis em 1902. Mas só em 1927, Walter Heitler e Fritz London mostraram como esta partilha de electrões estabiliza uma molécula covalente em relação aos átomos constituintes. O modelo de Heitler-London é a base da Teoria do Enlace de Valência. Linus Pauling teve um papel importante para o desenvolvimento da teoria com a introdução do conceito de orbitais híbridas.
A teoria do Enlace de Valência descreve a ligação química em termos do enlace ou sobreposição de orbitais de valência semipreenchidas dos átomos constituintes da molécula em análise. Nalguns casos pode haver formação de uma ligação dita covalente dativa por sobreposição de uma orbital totalmente preenchida de um átomo com uma orbital vazia de outro. Exemplificando com a molécula de H2:

Á medida que os átomos de hidrogénio se aproximam começa a haver sobreposição das orbitais 1s de cada átomo, ou seja, os electrões ficam sujeitos à atracção simultânea dos dois núcleos. A distância internuclear de equílibrio corresponde à distância em que são maximizadas as atracções entre os dois electrões e os dois núcleos e minimizadas as repulsões electrónicas e nucleares. A sobreposição das orbitais atómicas 1s dá origem a uma ligação sigma (ligação formada por sobreposição topo a topo de orbitais de valência em que o máximo de probabilidade de encontrar o electrão se situa sobre o eixo internuclear).
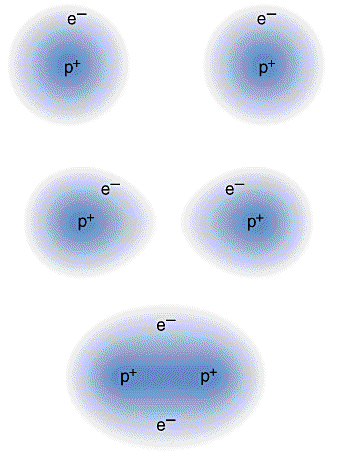
A molécula de H2 é fácil de descrever à luz da TEV uma vez que o átomo de hidrogénio apresenta apenas uma orbital de valência. Mas como são descritas as ligações em moléculas para as quais os átomos constituintes apresentam outras orbitais?
Consideremos outra molécula diatómica, o azoto molecular, N2. O azoto tem configuração electrónica 1s2 2s2 2p3, logo tem cinco electrões de valência e três electrões em orbitais 2p semipreenchidas. A sobreposição das orbitais 2px dos dois átomos de azoto dá origem a uma ligação, e a sobreposição lateral das orbitais 2py 2pz dá origem a ligações em que a probabilidade de encontrar os electrões na eixo internuclear é nula, ou seja, em que há um plano nodal. Estas ligações são designadas ligações pi (
).
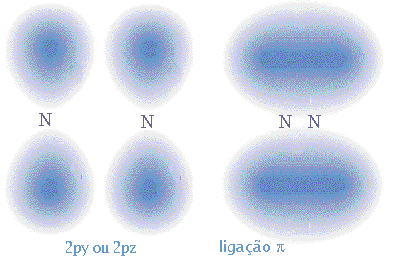
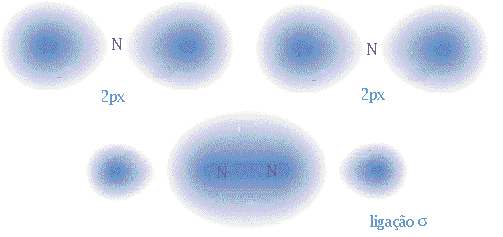
- Uma ligação covalente corresponde à sobreposição de duas orbitais atómicas;
- Quanto maior for a sobreposição de duas orbitais mais forte é a ligação;
- Sobreposição topo a topo de orbitais atómicas dá origem a uma ligação sigma (
);
- Sobreposição lateral de orbitais atómicas dá origem a uma ligação pi (
).
- Se a sobreposição for direccional então a ligação é direccional.
2002 Palmira Silva