Exercícios
resolvidos 1: Dualismo onda-corpúsculo;
propriedades
periódicas e Teoria de Orbitais Moleculares
Exercícios resolvidos 2
1. Descreva a estrutura molecular do acrilonitrilo, CH2CHCN,
indicando (i) ângulos de ligação aproximados, (ii)
tipos de ligação (iii) hibridações dos
átomos (iv) e, se existirem, o número de orbitais
deslocalizadas e de electrões que as ocupam.

- O carbono 1 apresenta hibridação sp2
logo os ângulos entre as as ligações estabelecidas
por este átomo são de
aproximadamente 120º;
- O carbono 2 apresenta uma hibridação sp2
e os ângulos das ligações estabelecidas por este
átomo são de ~120º;
- O carbono 3 apresenta hibridação sp os
ângulos das ligações estabelecidas por este
átomo são de ~180º;
- O azoto apresenta hibridação sp.
Há duas ligações π deslocalizadas, ou seja,
as orbitais 2pz dos C e do N formam um sistema π
deslocalizado
constituído por 4 orbitais π, 2 ligantes preenchidas com os
4 electrões disponíveis e 2 antiligantes vazias.
1. O acrilonitrilo dá origem a um polímero de
fórmula - (CH2CHCN)-n.
i) Classifique este polímero
ii) Quais as interacções que se estabelecem entre as
cadeias deste polímero?
i) Este polímero é um homopolímero de
adição.
ii) A unidade repetitiva deste polímero (o mero) é polar:

Entre as cadeias deste polímero estabelem-se todas as
forças de van der Waals (forças de Keesom, Debye e
London) sendo as
forças de London as mais importantes. Não existem
ligações de hidrogénio
2. A polimerização de acrilamida origina a
poliacrilamida,
um polímero solúvel em água. Após ser
sujeito
a cross-links químicos, este polímero forma um gel por
absorção
de água, utilizado industrialmente na
produção
de lentes de contacto flexíveis.
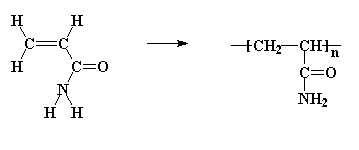
a) Classifique este polímero quanto à
reacção
de polimerização;
b) Explique a solubilidade deste polímero em
água
e a formação de um gel após os cross-links.
a) A poliacrilamida é um homopolímero de
adição.
b) A poliacrilamida é um polímero polar,
em
que se estabelecem entre as cadeias todas as forças de van der
Waals
e ligações de hidrogénio. A água é
um
composto polar, estabelecendo-se entre moléculas de água
todas
as interacções de van der Vaals e ligações
de
hidrogénio que são as determinantes das propriedades
físicas
da água. Quando se dissolve acrilamida em água
estabelecem-se
interacções de van der Waals entre as cadeias e a
água
e fortes ligações de hidrogénio entre o grupo
amida
(-CONH2)e a água. Após os estabelecimento dos
crosslinks
as cadeias ficam ligadas por ligações químicas
pelo
que já não é possível dissolver (separar as
cadeias)
o polímero em água, masentre as cadeias de
polímero
ligam-se moléculas de água (por ligações de
hidrogénio)
formando o referido gel.
- Esboce o diagrama de bandas do crómio (Cr),
explicitando o número de níveis de energia por
átomo e
o grau de preenchimento da banda. Justifique o facto de este ser um dos
elementos do 4º período da TP com maior temperatura de
fusão.
Configuração electrónica do crómio: 1s2
2s2 2p63s2 3p64s1 3d5
A banda de níveis de energia no crómio é
descrita por funções de onda obtidas por
combinação linear das orbitais atómicas de
valência do crómio ( as orbitais
4s,
3d e
4p
) que dão origem a uma banda com 9N níveis de energia,
dos quais 3N têm
energia inferior às orbitais atómicas.

Os 6 electrões de valência de valência do
crómio vão ocupar as 3N orbitais ligantes de forma que a
energia de coesão no crómio é muito elevada. Como
a temperatura de fusão aumenta com o aumento da energia de
coesão, o crómio é um dos metais de maior
temperatura de fusão da TP.
III
1. Considere as seguintes substâncias: potássio (K),
cloreto de potássio (KCl), hidreto de potássio
(KH), crómio (Cr) e germânio (Ge).
- Classifique-as, justificando a sua resposta, do ponto
de vista da natureza da ligação química.
- Calcule a densidade do KCl (estrutura tipo cloreto de
sódio) r(K+)= 133 pm, r(Cl- )= 181 pm.

1. Descrever a ligação química equivale a
caracterizar
os electrões de valência nas espécies
químicas
em análise. O potássio e o crómio, elementos pouco
electronegativos, são metais e como tal os
electrões de valência nestes materiais ocupam orbitais
metálicas obtidas por combinação linear ou
interferência das orbitais de valência 4s, 3d
e 4p que dão origem a um contínuo de
níveis de energia que compreende 9N orbitais.
O germânio é um elemento representativo da TP, de maior
electronegatividade que os metais (é um semicondutor ou
metalóide) apresenta configuração
electrónica de valência 4s2 e 4p2
(as orbitais 3d
estão completamente preenchidas). O germânio sólido
é um cristal covalente em que cada átomo de
germânio na rede cristalina está ligado a 4 outros
átomos de germânio numa geometria tetraédrica. Os
electrões de valência do germânio ocupam assim
orbitais deslocalizadas que são
obtidas por combinação linear das orbitais sp3do
germânio. As bandas de valência e condução
estão separadas por um gap de energia (Eg).

Os compostos cloreto de potássio KCl e hidreto de
potássio KH são compostos iónicos, ou seja,
há transferência de um electrão do potássio
para o cloro e para o hidrogénio respectivamente, dando origem a
uma estrutura cristalina de catiões K+ e
aniões (Cl- ou H- ) estabilizada pela
energia de rede ou energia reticular. A diferença
de electronegatividade entre o potássio e o hidrogénio
é de apenas 1.4, pelo que este composto iónico
apresentará um carácter covalente elevado.
Electronegatividade do potássio (K) = 0.82
Electronegatividade do cloro (Cl) = 3.16
Electronegatividade do hidrogénio (H) = 2.2
2. Analisando a célula unitária do KCl verifica-se que
é uma estrutura CFC de catiões K+ em que os
aniões ocupam os interstícios octaédricos
(recordar que numa
estrutura CFC o número de interstícios octaédricos
é igual ao número de átomos na célula
unitária) logo há:
4 catiões K+ e 4 aniões Cl-
na célula unitária
ou contando o número de catiões na célula
unitária (uma vez que a estequiometria do composto é 1:1
há o
mesmo número de catiões e aniões na célula
unitária)
nº de catiões na célula unitária= 6 (K+
no centro das faces)x 1/2 (partilhados entre duas células
unitárias) + 8 (K+ nos vértices)x
1/8 (partilhados entre oito células unitárias) =
4
A aresta do cubo é igual a :
a= 2 rcatião + 2 ranião = 2x133 +
2x181 pm = 628x10-12 m = 628x10-10 cm
ρ (KCl) = 4 x [MM (K) + MM (Cl)]/ NA x (628x10-10)3
ρ (KCl) = 4 x(39.098+35.453)/6.022x1023 x (628x10-10)3
= 2 g cm-3




