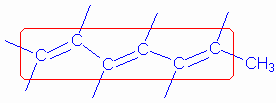
1. Calcule o comprimento de onda correspondente à transição 0-0 da banda de absorção de menor energia no UV-Vis do 1,3,5-heptatrieno (CH2CHCHCHCHCHCH3) previsto pelo modelo da partícula na caixa. Admita dC-C= 141 pm.

Esta molécula apresenta 6 electrões π deslocalizados, logo estão preenchidas as orbitais com n=1, n=2 e n=3. O modelo prevê que a transição de menor energia se dê entre as orbitais com n=3 e n=4. O comprimento da caixa corresponde a 6 dC-C.
Comprimento da caixa, L = 6 x dC-C=
6 x 141 pm = 846 pm = 8.46 x
10–10
m
Número de electrões π na caixa (1 por cada átomo
de
carbono na cadeia) = 6
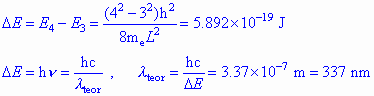
2. No contexto do modelo da partícula na caixa linear de potencial quais os números quânticos que caracterizam um electrão num dado nível?
n (número quântico principal), e ms
(número quântico magnético de spin)
3. Considere a molécula de 1,3-butadieno [CH2CHCHCH2]. Explique como o modelo da partícula numa caixa unidimensional de potencial prevê comprimentos de ligação C1-C2 mais curtos que o do ligação C2-C3. Calcule o comprimento de onda da transição de menor energia no UV-Vis previsto por este modelo e compare com o valor experimental (238 nm).
Esta molécula apresenta quatro
electrões
π deslocalizados, logo estão preenchidas as orbitais com n=1 e
n=2.
As funções de onda que descrevem estes electrões
são
representadas na figura, onde se representa igualmente o
quadrado
das funções de onda e a sua soma. Como vemos, a densidade
electrónica
entre C2 e C3 é menor do que entre C1 e C2, que é
idêntica
à densidade electrónica entre C3 e C4 (isto devido ao
nodo
que a função de onda n=2 apresenta no centro da caixa).
Logo
a distância internuclear C2 e C3 é maior.

Este modelo prevê que a transição electrónica de menor energia se dê entre as orbitais com n=2 e n=3. O comprimento da caixa corresponde a 4 dC-C
ΔE = E3-E2
L = 4x 1.21x10-10 m = 4.84 x10-10
m
ΔE = h2 (32-22) /
8 m (4.84x10-10)2
ΔE = h ν = h c / λ
λ = h c / ΔE
λ= 2.1x10-7 m =
210
nm
A surpreendente pequena diferença* entre o comprimento de onda de absorção do butadieno previsto pelo modelo e o valor experimental é devida às aproximações do modelo:
4. Explique quantitativamente a seguinte afirmação: O neon tem uma energia de ionização elevada e uma electroafinidade baixa.
A energia de ionização e a electroafinidade são proporcionais à razão (Zef /n)2 para o electrão em causa.
Configuração electrónica do Ne: (1s2)(2s2 2p6) Configuração electrónica do Ne-: (1s2 )(2s2 2p6)(3s1)
EI(Ne) é proporcional a (Zef
/n)2(2p, Ne)
EA(Ne) é proporcional a (Zef /n)2(3s,
Ne-)
Zef (2p, Ne) = 10 - (7x0.35 + 2x0.85) = 5.85
Zef (3s, Ne-) = 10 - (8x0.85 + 2x1) = 1.2
(Zef /n)2 (2p, Ne) =
(5.85/2)2=
8.56
(Zef /n)2 3s, Ne-) = (1.2/3)2=
0.16
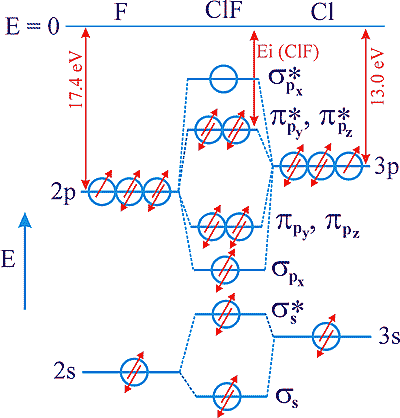
5. Explique os valores experimentais das energias de ionização do azoto (N) e do oxigénio (O) que encontra na Tabela Periódica.
A energia de ionização é proporcional à razão (Zef /n)2 para o electrão em causa.EI(F) = 17.4 eV
EI(Cl) = 13.0 eV
Configuração electrónica
de
valênciado flúor: 2s2 2p5
Configuração electrónica do cloro: 3s2
3p5
Uma vez que a energia de ionização do F é maior que a energia de ionização do Cl as orbitais 2p do flúor têm menor energia. Representando apenas as orbitais de valência de ambos os átomos tem-se:
electronegatividade: χ F =3.98 e χ Cl =3.16
Δχ = 0.82 a que
corresponde
(lido na Tabela Periódica) uma percentagem de carácter
iónico
%CI= 15%
momento dipolar
μLiF = %CI/100 x e (carga do electrão) x dClF
dClF = rcov(Cl) + rcov (F) = (99 + 72) x10-12 m = 171 x10-12 m
μClF = 0.15 x 1.6x10-19 C
x 171 x10-12m = 4.10 x10-30 C.m = 1.2 D
6. a) Desenhe o diagrama de orbitais moleculares do
monóxido
de azoto (NO), identificando no mesmo diagrama as energias de
ionização
dos átomos constituintes e os tipos de orbitais moleculares
(sigma,
pi, etc.) envolvidas. Determine a ordem de ligação no NO
e
preveja as propriedades magnéticas da molécula.
b) Utilizando os dados da Tabela Periódica
faça
uma estimativa do momento dipolar da molécula HF.
EI(N) = 14.5 eV
EI(O) = 13.6 eV
Configuração electrónica
do
azoto: 1s22s2 2p3
Configuração electrónica do oxigénio: 1s2
2s2 2p4
Uma vez que a energia de ionização do N é maior que a energia de ionização do O as orbitais 2p do azoto têm menor energia. Representando apenas as orbitais de valência de ambos os átomos tem-se:

OL = (nº de electrões ligantes
-
nº de electrões antiligantes)/2= (8 -3 )/2 = 2.5
A molécula é paramagnética.
b)
electronegatividade: χH=2.2 e χF=3.98
Δχ = 1.78 a que
corresponde
(lido na Tabela Periódica) uma percentagem de carácter
iónico
%CI= 55%
momento dipolar
μHF = %CI/100 x e (carga do
electrão)
x dHF
dHF = rcov(H) + rcov (F) = (30 + 72)
x10-12
m = 102 x10-12 m
μHF = 0.55 x 1.6x10-19 C
x 102 x10-12m = 8.976 x10-30 C.m = 2.7 D
| Biomédica, MEFT |