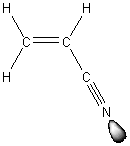
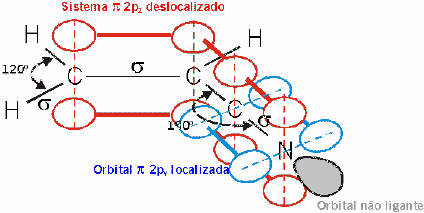
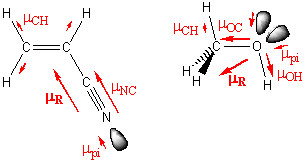
|
VI/VII.1
Considere uma liga de ouro com 10% (percentagem
atómica) em platina
(i) Indique o tipo de liga que se forma
Solução sólida de substituição (átomos de raio
semelhante e electronegatividades semelhantes).
(ii) Considerando que o Au cristaliza numa estrutura CFC e tem um raio metálico de 1.79 Å, calcule a massa volúmica desta liga
A massa volúmica será:
r = (massa dos átomos
numa célula base) / (volume da célula base)
Volume da célula base
Na estrutura CFC os átomos tocam-se segundo a diagonal da face do
cubo, d.
Supondo que a Pt não deforma a estrutura, d = aÖ2 =
4 r(Au) = 7.16´10-8
cm
A aresta da célula base será a = 5.06´10-8
cm
E o volume da célula base V(cb) = a3 = 1.295´10-22
cm3
Massa dos átomos
numa célula base
Numa célula base há (6´1/2
+ 8´1/8 =) 4 átomos, 0.90´4
de Au e 0.10´4 de Pt
MA(Au) = 196.97 g/mol, ma(Au) = MA/NA = 3.27´10-22
g/átomo
MA(Pt) = 195.09 g/mol, ma(Pt) = MA/NA = 3.24´10-22
g/átomo
A massa da célula base será: M(cb) = 0.90´4´ma(Au)
+ 0.10´4´ma(Pt)
= 1.307´10-21
g
Logo a massa volúmica será 10.1 g/cm3.
VI/VII.2
1. Em cada par de compostos a seguir indicados
seleccione o de maior dureza. Justifique.
i) NaF e KCl
ii) KCl e CaCl2
Em princípio, o de maior dureza será o que tiver
maior |U| (energia de rede).
Admitimos que as diferenças entre as constante de Madelung, A, e os expoentes de Max Born, n, não afectam as conclusões
|U| µ
Zcatião ´
Zanião / r0
i) Zcatião
´ Zanião(NaF)
= Zcatião ´
Zanião(KCl) = 1 ; r0(NaF) < r0(KCl). Logo
dureza(NaF) > dureza(KCl).
ii) Zcatião ´
Zanião(KCl) = 1, Zcatião
´ Zanião(CaCl2)
= 2 ; r0(KCl) > r0(CaCl2). Logo
dureza(CaCl2) > dureza(KCl).
2. Em cada par de substâncias a seguir indicadas
indique a de maior temperatura de fusão. Justifique.
i) Na e Al
São ambos metais. A energia de coesão e (temperatura
de fusão) será tanto maior quanto maior for o grau de preenchimento dos níveis ligantes.
N átomos de Na : banda de Bloch com 4N
níveis (3s+3p), com N electrões, 0.5N níveis preenchidos.
N átomos de Al : banda de Bloch com 4N níveis (3s+3p), com 3N
electrões, 1.5N níveis preenchidos.
TF(Al) > TF(Na)
ii) CO2 e Cdiamante
CO2 : composto molecular (interacções de London)
Cdiamante: cristal covalente (energia de
ligação pelo menos uma ordem de grandeza superior à das interacções moleculares)
TF(Cdiamante) >> TF(CO2)
VI/VII.3
Considere as seguintes substâncias: potássio (K), cloreto de
potássio (KCl), hidreto de potássio (KH), crómio (Cr) e germânio
(Ge).
1. Classifique-as,
justificando a sua resposta, do ponto de vista da natureza da ligação química.
K e Cr metais: átomos idênticos de electronegatividade muito baixa. Bandas de valência e de condução sobrepostas.
Ligação deslocalizada.
KCl e KH cristais iónicos: grande
diferença de electronegatividades (ci(KCl) = 74%, ci(KH) = 39%). No caso do KH a
% de carácter covalente é elevada mas em qualquer deles o "gap" entre as
orbitais ligantes (banda de condução) e antiligantes (banda de valência) é
elevado. Ligações localizadas.
Ge Semicondutor: metal (metaloide) de
elevada electronegatividade. As bandas de condução e valência estão
afastadas embora o "gap" seja pequeno. Ligações deslocalizadas.
2. Esboce o diagrama de bandas do crómio (Cr), explicitando o
número de níveis de energia por átomo e o grau de preenchimento da
banda. Justifique o facto de este ser um dos elementos do 4º período
da TP com maior temperatura de fusão.
Cr [Ar] 3d5 4s1 4p0
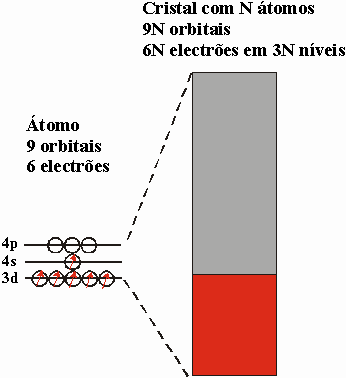
Tem 1/3 da banda preenchida
Logo os níveis ligantes estão preenchidos (cerca de 1/3 da banda). Donde a
elevada energia de coesão e ponto de fusão.
3.
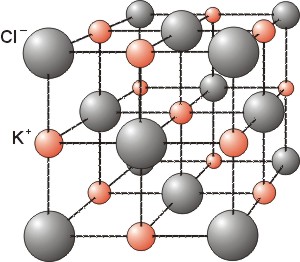
Calcule a densidade do KCl (estrutura tipo cloreto de sódio)
r(K+) = 133 pm, r(Cl- ) = 181 pm.
A massa volúmica do KCL será:
r = (massa dos iões
numa célula base) / (volume da célula base)
Nesta estrutura o catião tem coordenação octaédrica.
A aresta da célula base será a = 2 r(K+)
+ 2 r(Cl-) = 6.28´10-8
cm
Podemos confirmar que os aniões não se tocam pois a diagonal da face d
= aÖ2 = 8.88´10-8
cm > 4 r(Cl-) = 7.24´10-8
cm
O volume da célula base será V (cb) = a3 = 2.48´10-22
cm3
Numa célula base há (6´1/2
+ 8´1/8 =) 4 aniões e (1 + 12´1/4
=) 4 catiões
MA(K) = 39.09 g/mol, ma(K) = MA/NA = 6.49´10-23
g/átomo
MA(Cl) = 35.45 g/mol, ma(Cl) = MA/NA = 5.89´10-23
g/átomo
A massa da célula base será: M(cb) = 4.95´10-22
g
Logo a massa volúmica será 2.00 g/cm3
e a densidade calculada 2.00.
VI/VII.4
1. Esboce o diagrama de bandas de energia do óxido de magnésio (MgO)
e do titânio (Ti) e indique o grau de preenchimento das mesmas.
2.
Calcule a densidade de um aço com 0,1% (percentagem atómica) de
carbono.
3. Ordene por ordem crescente de dureza as seguintes substâncias,
justificando em detalhe a sua resposta.
i) Titânio (Ti) e cálcio (Ca)
ii) Fluoreto de cálcio
(NaF), óxido de magnésio (MgO) e óxido de bário
(BaO).
VI.5
|
O
ponto de fusão do zinco (Z=30) é 420º C e o do cobre (Z=29) 1085º C. A razão
para esta diferença é: |
|
c |
66.7%
da banda de Bloch do zinco estão preenchidos enquanto que só 61.1% da do
cobre está preenchida. Logo, o zinco tem mais electrões em níveis
antiligantes e a energia de coesão será menor para este elemento. |
|
c |
A
banda de Bloch de ambos possui 6N níveis (orbitais cristalinas), mas o cobre
tem mais orbitais ligantes preenchidas. |
|
c |
66.7%
da banda de Bloch do zinco estão preenchidos enquanto que só 61.1% da do
cobre está preenchida. Logo, o zinco tem menos electrões em níveis
antiligantes e a energia de coesão será menor para este elemento. |
|
c |
A
energia de coesão depende da energia reticular, U, que é superior no
zinco devido ao menor raio. |
|
c |
Quanto mais electrões os metais têm, menor o seu ponto de fusão (a
coesão diminui ao longo de um período). Como o zinco tem mais electrões,
terá menor energia de coesão do que o cobre. |
VI/VII.6
Justifique as seguintes observações.
i) O
titânio (Ti) tem maior dureza do que o cálcio (Ca).
ii) O
óxido de magnésio (MgO) tem maior dureza do que o óxido de bário (BaO).
|