Discuta detalhadamente a miscibilidade do benzaldeído, C6H5CHO, em benzeno, C6H6.
O benzaldeído é uma molécula polar com elevada polarizabilidade.
Apresenta todas as forças de van der Waals (Keesom, Debye e London)
sendo as forças de London as forças mais importantes. O benzeno
é uma molécula apolar; apresenta apenas forças de London,
que são intensas dada a elevada polarizabilidade do benzeno. Entre
as moléculas de benzaldeído e benzeno estabelecem-se forças
de Debye (fracas) e forças de London intensas uma vez que ambas as
moléculas são muito polarizáveis. O balanço é
favorável, ou seja, as forças intermoleculares na mistura são
comparáveis às dos compostos puros logo a entalpia de
mistura deve ser próxima de zero; como a entropia de mistura é
sempre positiva os dois líquidos devem ser miscíveis.
| m. dipolar |
Keesom |
Debye |
London |
Lig. Hidrogénio |
|
| C6H5CHO |
#0 |
+ |
+ |
+++ |
- |
| C6H6 |
=0 |
- |
- |
+++ |
- |
| C6H5CHO + C6H6 |
- |
+ |
+++ |
- |
|
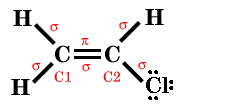
2- Descreva a estrutura molecular do cloreto de vinilo, CH2CHCl, indicando (i) ângulos de ligação aproximados, (ii) tipos de ligação (iii) hibridações dos átomos (iv) e, se existirem, o número de orbitais deslocalizadas e de electrões que as ocupam.
| m. dipolar |
Keesom |
Debye |
London |
Lig. Hidrogénio |
|
| CH2CHBr |
#0 |
+ |
+ |
+++ |
- |
| CH3(CH2)4CH3 |
=0 |
- |
- |
+++ |
- |
| CH2CHBr + CH3(CH2)4CH3 |
- |
+ |
+++ |
- |
|
3-
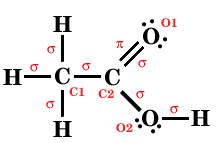
Descreva a estrutura molecular do ácido acético, CH3COOH,
indicando (i) ângulos de ligação aproximados, (ii) tipos
de ligação (iii) hibridações dos átomos
(iv) e, se existirem, o número de orbitais deslocalizadas e de
electrões que as ocupam.

| m. dipolar |
Keesom |
Debye |
London |
Lig. Hidrogénio |
|
| CH3COOH |
#0 |
+ |
+ |
+++ |
+++ |
| CH3CH2OH |
#0 |
+ |
+ |
+++ |
+++ |
| CH3COOH + CH3CH2OH |
+ |
+ |
+++ |
+++ |
|