3 x μC-Cl x cos (180-109,5) = 3 x μC-Cl x 0.333(3) = μC-Cl
O momento dipolar μ de uma molécula poliatómica é a soma vectorial dos momentos dipolares associados ás ligações polares e aos pares de electrões não partilhados, sendo assim determinado pela geometria da molécula. A molécula de tetracloreto de carbono, CCl4, tem quatro ligações C-Cl polares mas é apolra (mu=0) uma vez que a soma dos momentos dipolares é nula.
 |
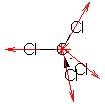
Figura xx-1 A resultante dos
momentos dipolares associados às 4 ligações C-Cl, μC-Cl,
é igual a zero uma vez que projectando três vectores
segundo a direcção do quarto obtemos um vector com o
mesmo módulo mas sentido oposto: 3 x μC-Cl x cos (180-109,5) = 3 x μC-Cl x 0.333(3) = μC-Cl |
De igual forma, no trifluoreto de boro, BF3, os momentos dipolares associados às ligações B-F anulam-se:
 |
Figura xx-2 A resultante dos
momentos dipolares associados às 3 ligações B-F, μB-F,
é igual a zero uma vez que projectando dois vectores
segundo a direcção do terceiro obtemos um vector com o
mesmo módulo mas sentido oposto: 2 x μB-F x cos 60º = 2 x μC-Cl x 0.5 = μB-F |
A tabela 1 mostra os momentos dipolares
parciais
e
globais de algumas moléculas. São igualmente
representadas superfícies de
densidade electrónica para essas moléculas com uma
notação de cores em que o vermelho indica zonas de
elevada densidade electrónica (cargas negativas) e o
azul indica zonas de baixa densidade electrónica (cargas
positivas).
Tabela 1- Momentos dipolares parciais e globais do CH3Cl,
CH2Cl2,CHCl3, CCl4, NH3
e CH2O. Superfícies de densidade electrónica
destas moléculas em que as zonas a vermelho indicam elevada
densidade electrónica e a azul baixa densidade
electrónica.
|
|
|
|
| CH3Cl |
|
|
| CH2Cl2 |
|
|
| CHCl3 |
|
|
| CCl4 |
|
|
| NH3 |
|
|
| CH2O |
|
|