Tópico 39 - Hibridação sp3: CH4
O carbono (configuração electrónica 2s22p2) tem quatro orbitais de valência e quatro electrões para as preencher. Assim, tem capacidade para formar quatro ligações.
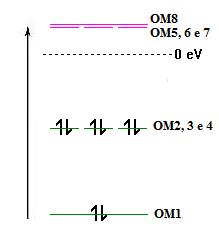
A molécula de CH4 é uma molécula que apresenta geometria tetraédrica e em que o carbono estabelece quatro ligações equivalentes com os átomos de hidrogénio. Recorrendo á Teoria de Orbitais Moleculares para descrever esta molécula, tem-se oito orbitais moleculares, quatro orbitais ligantes ocupadas e quatro orbitais antiligantes vazias, obtidas por combinação linear de todas as orbitais de valência dos átomos constituintes como indicado na equação 1:
ψi= ci1 φ2s (C) + ci2 φ2px (C) + ci3 φ2py (C) + ci4 φ2pz (C) +ci5 φ1s (H1) + ci6 φ1s(H2) + ci7 φ1s(H3) + ci8 φ1s(H4) (eq.1)
As orbitais híbridas de valência do carbono que descrevem a ligação neste composto correspondem aos quatro primeiros termos da Equação 1, isto é, são obtidas misturando as três orbitais 2p com a orbital 2s como indicado na Fig. 1:|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Figura 1- Combinação linear das orbitais 2s e 2p na hibridação sp3.
As quatro orbitais híbridas sp3 são equivalentes quer em termos energéticos quer de «composição»: as orbitais são degeneradas, com energia Esp3= 1/4 Eφ2s +3/4 Eφ2p e apresentam 25% de carácter s e 75% de carácter p. O carbono no metano tem assim assim uma configuração electrónica: [He] sp31sp31sp31sp31.
As orbitais híbridas sp3 dirigem-se segundo os ângulos de um tetraedro e apresentam sobreposição máxima com a orbital 1s de cada um dos hidrogénios. O metano é descrito como apresentando quatro ligações σ (localizadas) resultantes da sobreposição ou enlace topo a topo das orbitais 1s do hidrogénio com as orbitais híbridas sp3 do carbono.
 |
|