Moléculas
Poliatómicas
Hibridação sp2: BH3
O boro (configuração electrónica 2s22p1) tem quatro orbitais de valência e apenas três electrões para as preencher. Assim, tem capacidade de estabelecer três ligações covalentes «normais» - e uma ligação covalente dativa nos casos em que se liga a elementos com orbitais totalmente preenchidas (os pares de electrões não partilhados).
A molécula de BH3 é uma
molécula que apresenta geometria triangular plana em que o boro
estabelece três ligações equivalentes com os
átomos de
hidrogénio. Na descrição pela teoria de
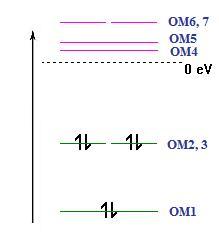
orbitais moleculares do BH3,
obtém-se sete orbitais moleculares de
valência por combinação linear das orbitais
atómicas de valência dos átomos
constituintes. Considerando o plano da molécula o plano XY, o
critério da sobreposição espacial indica que
não é possível
combinar a orbital 2pz
do B com as
orbitais 1s
do hidrogénio uma vez que a sua sobreposição
é nula. Assim, a orbital de simetria π OM4 do BH3
é uma
orbital não ligante, que corresponde à orbital
atómica 2pz
do B, e as restantes seis orbitais moleculares, de simetria σ,
são obtidas por
combinação linear das orbitais 2s, 2px e 2py do boro com as
orbitais 1s dos
hidrogénios como indicado na equação 1. As
três orbitais de menor energia estão ocupadas pelos seis
electrões de valência da molécula.
ψi= ci1 φ2s (B) + ci2 φ2px (B) + ci3 φ2py (B) + ci4 φ1s H(1) + ci5 φ1sH(2) + ci6 φ1sH(3) (eq.1)
A mistura s-p nas OM do BH3 traduz-se, na linguagem do enlace de valência, na hibridação sp2 atribuída ao boro no BH3. As orbitais híbridas de valência do boro que descrevem a ligação neste composto são obtidas misturando duas orbitais 2p com a orbital 2s como indicado na Fig. 1.
|
|
|
|
|
|
|
|
|
|
|
|
Figura 1- Combinação linear das orbitais 2s, 2px e 2py na hibridação sp2.
As três orbitais híbridas sp2 são equivalentes quer em termos energéticos quer de «composição»: as orbitais são degeneradas, com energia Esp2= 1/3 Eφ2s +2/3 Eφ2p e apresentam 33,(3)% de carácter s e 66,(6)% de carácter p. A orbital p que não entrou na hibridação permanece «pura» e está vazia no boro que apresenta assim uma hibridação sp2 no BH3 e uma configuração electrónica: [He] sp21sp21sp21pz0.
A geometria das orbitais sp2 indica que há sobreposição máxima de cada orbital híbrida com apenas a orbital 1s de um dos hidrogénios. BH3 é então descrito como apresentando três ligações σ resultantes da sobreposição ou enlace topo a topo das orbitais 1s do hidrogénio com as orbitais híbridas sp2.
 |
|