Moléculas
Poliatómicas
Hibridação sp: BeH2
O berílio (configuração electrónica 2s22p0) tem quatro orbitais de valência e apenas dois electrões para as preencher. Assim, o berílio tem capacidade de estabelecer duas ligações covalentes «normais» - e duas ligações covalentes dativas nos casos em que se liga a elementos com orbitais totalmente preenchidas (os pares de electrões não partilhados).
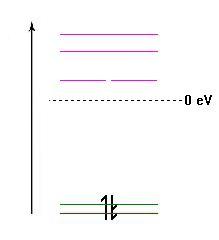
A molécula de BeH2 é uma molécula linear em que o berílio estabelece duas ligações equivalentes, uma com cada átomo de hidrogénio. Recorrendo às orbitais atómicas «puras» do berílio, e considerando que na molécula o Be teria uma configuração electrónica 2s12p1, seria possível estabelecer uma primeira ligação Be-H utilizando uma orbital 2p semipreenchida do Be. Pelo critério da sobreposição máxima, esta ligação seria direccional. Uma segunda ligação poderia ser estabelecida com a orbital 2s do Be, sendo em princípio adireccional dada a simetria esférica da orbita 2s. No entanto, a repulsão entre os electrões envolvidos nas duas ligações é mínima para um ângulo de 180º entre elas, sendo por isso esta a orientação de menor energia. Considerando o eixo dos xx o eixo internuclear, as orbitais 1s dos dois átomos de H terão então ambos sobreposição (interferência) tanto com a orbital 2s como com a orbital 2px do átomo de Be [link para moléculas diatómicas]. As orbitais 2py e 2pz do Be têm coalescência (sobreposição) nula com as restantes [link para moléculas diatómicas] permanecendo com carácter atómico (não ligantes). As 4 orbitais moleculares resultantes serão combinações lineares das orbitais 1s dos dois átomos de hidrogénio e das orbitais 2s e 2px do berílio, como indicado na Equação 1. Os 4 electrões de valência do BeH2 ocupam as duas orbitais moleculares de menor energia.
ψi=
ci1 φ2s
(Be) + ci2 φ2px
(Be) +
ci3 φ1s H(1) + ci4 φ1sH(2)
(eq.1)
Na aproximação do enlace de valência, em que
não se considera a formação de orbitais
moleculares mas sim o enlace de orbitais atómicas, dá-se
conta da mistura s-p
que ocorre na molécula «misturando» as orbitais 2px e 2s do berílio. De facto, os
dois primeiros termos da Eq. 1
são combinações lineares das orbitais 2s e
2px do Be e o conceito de
hibridação é assim simplesmente uma
operação matemática que combina as orbitais
atómicas do átomo isolado de forma a que as orbitais
resultantes sejam consistentes com a interferência de mais do que
duas orbitais.
|
|
|
|
|
|
|
|
|
Figura 1- Combinação linear das orbitais 2s e 2px na
hibridação sp.
As duas orbitais híbridas sp
são equivalentes quer em termos energéticos quer de
«composição»: as duas orbitais são
degeneradas, com energia intermédia entre a energias das duas
orbitais atómicas que lhe deram origem, e apresentam 50%
de carácter s e 50% de
carácter p. As duas
orbitais p que não entraram na hibridação
permanecem «puras» e estão vazias no
berílio que apresenta assim uma
configuração electrónica:
[He] sp1sp1pz0py0.
Figura 2- Orbitais atómicas envolvidas na ligação química no BeH2 .
Note-se que esta descrição simples tem limitações, e que dela resultam previsões em claro contraste com as derivadas da TOM. Por exemplo, a representação da Fig. 2 sugere que as duas orbitais σ são degeneradas e com contornos de isoprobabilidade simétricos em relação ao eixo dos xx. De facto, as orbitais σ têm energias diferentes e os respectivos contornos de isoprobabilidade não são simétricos (Fig. 3) mas as ligações formadas são equivalentes em termos de distâncias internucleares e em termos energéticos como previsto pelo modelo do EV. Assim, desde que as suas limitações sejam tidas em conta, o Enlace de Valência tem a enorme vantagem da sua simplicidade, em particular na descrição de moléculas grandes.
 |
|