Tópico 55- Deslocalização π:
polienos cíclicos conjugados
Esta
página utiliza Jmol. Se não estiver familiarizado com as
possibilidades do Jmol veja esta introdução.
Aromaticidade
Tal como nos seus análogos lineares (link polienos), os polienos
cíclicos conjugados possuem carbonos adjacentes com
hibridação sp2 e um sistema π deslocalizado.
Entre estes compostos destacam-se
os hidrocarbonetos aromáticos
(também chamados arenos) como o benzeno. Embora
a aromaticidade seja um dos mais discutidos conceitos da química
orgânica, não existindo um critério geral para
identificar o carácter aromático de um composto, o termo
é muito utilizado e existe um grande
número de
compostos classificados como aromáticos e
heteroaromáticos. A
reactividade química foi uma das primeiras
características a ser utilizada para distinguir compostos
aromáticos de polienos cíclicos «normais». Um
alceno, R1C=CR2 (link alcenos), reage, por
exemplo, com bromo, Br2, por adição
à ligação dupla dando origem ao alcano
substituído R1(Br)CC(Br)R2 . Nos compostos
primeiro designados como aromáticos não há
adição às
ligações duplas mas estes reagem com electrófilos
por substituição em reacções designadas
genericamente como
substituição electrofílica aromática, um
dos processos fundamentais da química orgânica, em que
há substituição de um hidrogénio por um
grupo electrófilo.
Outra forma de identificar um composto aromático
consiste na aplicação da regra de Hückel. Esta regra
sustenta que são aromáticos compostos planares
monocíclicos (anulenos) com sistemas com (4n+2) electrões
π. Sistemas contendo 4n electrões π prevê-se que sejam
não-aromáticos. Haddon redefiniu esta regra
considerando que em polienos com (4n+2) átomos de carbono
conjugados, a energia dos electrões π do anuleno C4n+2
H4n+2 será menor (ou seja, o composto cíclico
correspondente será mais estável ) que a dos polienos
lineares C4n+2 H4n+4. Em anulenos C4n H4n,
a energia dos eletrões π é maior que a dos
correspondentes polienos lineares C4n H4n+2 (ou
seja, são menos estáveis) e compostos como estes
são designados anti-aromáticos.
A explicação deste comportamento anti-aromático
decorre naturalmente
da descrição da ligação
química no anuleno de mais baixo peso
molecular, o ciclobutadieno. ( Fig. 1)
Fig. 1: Ligação
química no ciclobutadieno.
No ciclobutadieno as orbitais π2 e π3
são degeneradas de forma que este composto é
paramagnético. De acordo com o teorema de Jahn-Teller, com
excepção de moléculas lineares (como no caso do
oxigénio, O2 (link
TOM), moléculas com estados fundamentais degenerados
serão instáveis. O teorema prediz ainda que a geometria
da molécula será distorcida de tal modo a remover a
degenerescência. De facto, em relação ao butadieno
a energia dos electrões π é maior no anuleno
correspondente (Fig.2). Por uma questão de simetria, nos
anulenos planares apenas a orbital totalmente ligante e a orbital
totalmente anti-ligante não são degeneradas de forma que
quando existem 4n electrões π as últimas orbitais
ocupadas são duas orbitais degeneradas e apenas quando existem
(4n+2) átomos de carbono na cadeia a
molécula será diamagnética. Aliás, a
comparação da energia dos electrões π num polieno
linear e no equivalente cíclico pode ser outra forma de definir
aromaticidade: um composto é
aromático se a energia dos eletrões π do anel for menor
que a energia no composto de cadeia aberta e será
anti-aromático se for maior (se for igual, o anel resultante
é não aromático).
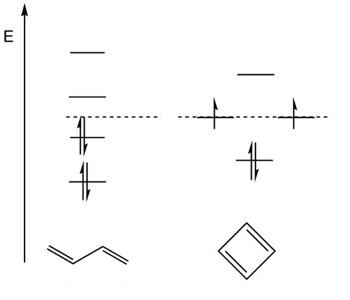
Fig. 2: Comparação da energia das orbitais
moleculares π no ciclobutadieno e
butadieno
Assim, para além do ciclobutadieno, os anulenos em C8,
C12 e C16 deverão ser
anti-aromáticos e, para
além do
benzeno, os anulenos com dez, catorze e dezoito átomos de
carbono
deveriam ser aromáticos. Na realidade, o ciclooctatetraeno
não é planar sendo melhor descrito como uma
molécula não aromática. Por seu lado, os 10, 12 e
14-anulenos são pouco estáveis por razões
estereoquímicas. Em anulenos de maiores
dimensões, as repulsões de van der
Waals com os
hidrogénios internos ao anel (identificados a vermelho nas
estruturas da Tabela 1) são minimizadas e as moléculas
são estáveis. O 16-anuleno, tal como o ciclooctatetraeno,
não é planar e apresenta ligações de
dimensões alternadas pelo que é igualmente descrito como
não aromático. O 18-anuleno é quase planar e
apresenta uma energia de ressonância de 418
kJ/mol,
o que indica um certo carácter aromático, embora esteja
longe da
estabilidade adicional do benzeno - e reaja
como um polieno, nomeadamente adiciona Br2. As geometrias
dos anulenos estáveis são indicadas na tabela
1.
Tabela 1- Geometria de anulenos estáveis
| Anuleno |
Estrutura
|
Ciclooctatetraeno
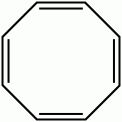
|
|
16-anuleno
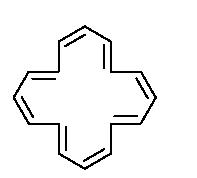
|
|
18-anuleno
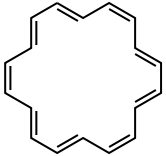
|
|
Heterociclos
A regra de Hückel pode ser estendida a qualquer polieno
cíclico conjugado (os polienos lineares são não
aromáticos), desde que este seja planar (para que
haja uma boa sobreposição entre as orbitais p).
Para além dos anulenos, são igualmente polienos
cíclicos conjugados os
compostos heterocíclicos, isto é, em que pelo menos um
dos carbonos de um dos anéis foi substituído por um
heteroátomo (que é normalmente azoto, oxigénio,
enxofre mas pode ser outro átomo como fósforo ou
arsénio) e os hidrocarbonetos
aromáticos policíclicos (HAPs). Os HAPs são
prevalecentes através do
Universo, isto é, como indicou o
telescópio espacial Spitzer da
NASA, são muito abundantes no espaço interestelar. De
igual forma, são muito abundantes os heterociclos
aromáticos policíclicos de azoto (HAPNs), formados em
grande escala em torno de estrelas moribundas. A clorofila, o composto
que permite a fotossíntese em plantas, é um bom
exemplo desta última classe de compostos.
Voltando à Terra, cerca de metade de todos os produtos naturais
são heterociclos, muitos dos quais
desempenham funções muito importantes nos organismos,
humano inclusive. Para além disso, muitos destes compostos
são farmacologicamente activos. Os alcalóides, por
exemplo, são uma família de heterociclos de azoto
naturais. A importância destes heterociclos conjugados é
apenas
exemplificada pelas bases do ADN, a adenina e a guanina (bases
derivadas
da purina) e a citosina e timina (bases derivadas da pirimidina, tal
como o uracilo presente no ARN) (Tabela 2).
Tabela 2 - Estrutura de alguns heterociclos aromáticos
Estrutura
|
Estrutura |
Furano
|
Triptofano
|
Tiofeno
|
Indol
|
Pirrol
|
Serotonina
|
Pirimidina
|
Purina
|
Piridina
|
Cafeína
|
Imidazol
|
Quinino
|
Ácido
ascórbico
(Vitamina C)
|
Indigo
|
Quer os heterociclos quer derivados de polienos cíclicos
são compostos ubíquos na Natureza,
tanto que um deles foi chamado ubiquinona (igualmente designado
coenzima Q10 nos humanos), uma benzoquinona presente em praticamente
todas as células (naquelas que possuem com mitocôndrias
onde participa nos processos de produção de ATP).
São igualmente muito abundantes os aldeídos (link aldeídos) derivados
de ácidos benzóicos (link
ácidos carboxílicos),
que são constituintes dos óleos essenciais de muitas
plantas, e os
compostos fenólicos que englobam desde moléculas pequenas
até compostos
poliméricos com graus variáveis de
polimerização, como sejam taninos,
ligninas e polímeros de leucoantocianidinas e catequinas (
por
exemplo, os teorubígenos e teoflavinas do chá
preto). Os polifenóis
constituem um grupo muito diversificado de compostos químicos
encontrados no mundo vegetal, que têm merecido a
atenção do público em
geral nas últimas décadas devido à descoberta das
suas propriedades
anti-oxidantes - são sequestradores (scavengers) de radicais
livres, o
que inibe inúmeras doenças mediadas por estas
espécias. Os polifenóis
incluem cumarinas, flavonóides, flavonas, flavonóis
(3-hidroxiflavonas
ou catequinas), chalconas, isoflavonas e ácidos fenólicos
e estão
presentes nos vegetais na forma livre ou ligados a
açúcares e proteínas.
Como nota de curiosidade, Faraday, que descobriu o benzeno, chamou-lhe
o que se pode traduzir
como «hidrogénio carboretado». Uns anos mais tarde,
o benzeno foi isolado da resina
balsâmica de algumas árvores, conhecida por
«benzoina». Mitscherlich,
que fez a descoberta, decidiu chamar benzina ao composto, mas este
nome, tal como o termo alternativo benzol, não teve
aceitação unânime por parecer incluir o composto na
família dos alcalóides ou dos álcoois. O nome hoje
em dia consagrado deve-se a Viktor
Meyer embora Auguste Laurent, um dos pioneiros da teoria atómica
moderna,
tenha sugerido mudar o nome para «phene» (feno), do grego phainen que significa brilho ou
brilhar. Embora o nome não tenha
«pegado» para designar o composto propriamente dito,
persiste no nome
de alguns derivados do benzeno, como os compostos fenólicos, e
em
compostos como o
fenantreno e seus derivados, para além da
designação fenilo aplicada ao
radical -C6H5.
Hidrocarbonetos
aromáticos policíclicos (HAPs)
Os hidrocarbonetos
aromáticos policíclicos (HAPs) constituem uma
família de compostos caracterizada por possuírem 2 ou
mais anéis
aromáticos condensados. A reactividade dos HAPs é
semelhante à do parente
benzeno mas são normalmente mais reactivos que o benzeno (e com
menor energia de ressonância por átomo de carbono).Rodando
as estruturas apresentadas
na Tabela 3 é possível confirmar a geometria plana
destas moléculas, que indica a existência de um extenso
sistema π deslocalizado, com excepção dos helicenos
que assumem uma forma helicoidal devido a impedimento
estereoquímico.
Tabela 3 . Estrutura de hidrocarbonetos
aromáticos policíclicos
Naftaleno
|
Fluoreno
|
Antraceno
|
Fenantreno
|
Criseno
|
Pireno
|
Pentaceno
|
Perileno
|
Trinaftileno
|
Coroneno
|
Hexaheliceno
|
Decaheliceno
|
À medida que estes sistemas aromáticos se tornam
maiores, a razão H/C diminui. Para um hexaciclo como o coroneno,
C24H12, esta razão diminui para metade do
valor unitário encontrado no benzeno. Aumentando o
número de anéis condensados esta razão tende para
zero e no limite o composto resultante seria uma forma de carbono. Esse
limite existe e corresponde à grafite (link grafite) e a novas formas
de carbono como sejam os fullerenos, os grafenos, ou nanotubos (link grafenos)






